Neurobiología de Circuitos y Trastornos Psiquiátricos
Neurobiology of Circuits and Psychiatric Disorders
Dr. Mariano Soiza Reilly
JEFE DE GRUPO / Team Leader
Investigador Independiente CONICET
Jefe de Trabajos Prácticos DFBMC-FCEN-UBA
msoizareilly@fbmc.fcen.uba.ar![]() @MSoizaReilly
@MSoizaReilly ![]() @soizareillylab
@soizareillylab
Las enfermedades psiquiátricas como la depresión, la ansiedad y la vulnerabilidad al estrés representan unas de las condiciones mentales más incapacitantes para la vida de los seres humanos. Recientes estudios sugieren que muchos aspectos de dichas patologías podrían tener un origen temprano durante la infancia de los individuos. Nuestro grupo está interesado en entender los mecanismos por los cuales modificaciones en la formación y maduración de circuitos cerebrales durante distintas etapas del neurodesarrollo pueden contribuir a la etiología temprana de enfermedades psiquiátricas.
Psychiatric disorders including depression, anxiety and stress vulnerability represent one of the main disabling conditions for individual’s life. Recent studies suggest that many aspects of these pathologies could have an early origin during childhood. Our team is interested in understanding how maladaptive neurodevelopmental mechanisms engaged in the maturation of neural circuits could contribute to the early etiology of psychiatric disorders.
Para comprender el origen temprano de enfermedades psiquiátricas como la ansiedad o la depresión utilizamos el ratón como modelo experimental, empleando un abordaje integral que incluye el uso de anatomía sináptica de alta resolución y distintas herramientas genéticas y fisiológicas, que nos permiten estudiar tanto la arquitectura de los circuitos cerebrales como así también su funcionalidad.
Early origins of Anxiety and Depression
To understand the early origins of psychiatric disorders including anxiety and depression we apply a multidisciplinary approach that includes high-resolution synaptic anatomy and novel genetic and physiological tools that allow us to explore the architecture and function of brain circuits in mice.
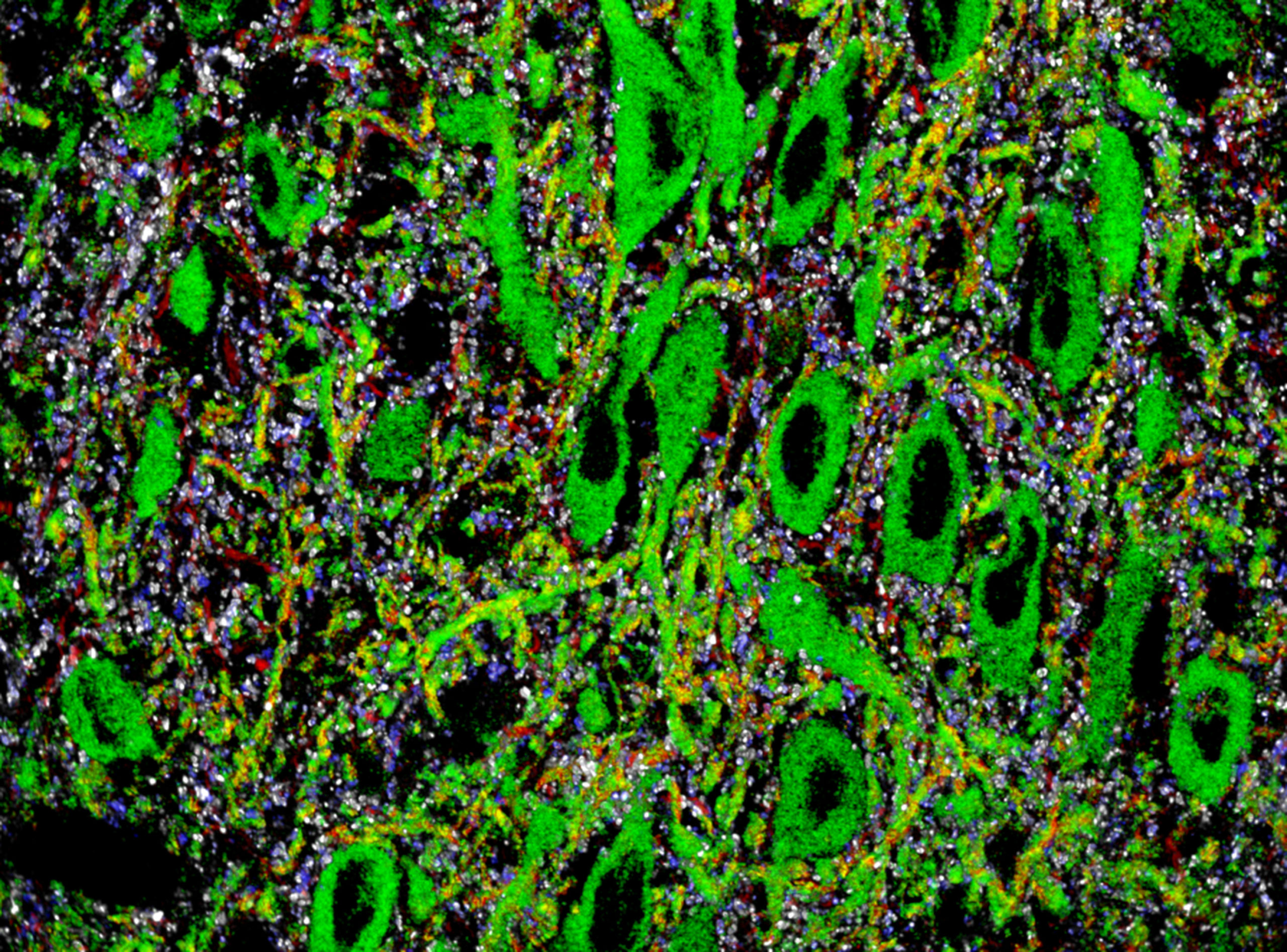
En nuestro laboratorio empleamos una técnica microscópica de fluorescencia de alta resolución denominada Array Tomography (ATom). ATom permite evaluar cuantitativamente la organización espacial y la arquitectura fina de los circuitos sinápticos presentes en el sistema nervioso. Dicho abordaje resulta de gran utilidad para investigar la presencia de cambios estructurales en los circuitos neurales que puedan contribuir a la fisiopatología de trastornos mentales.
Exploring Synaptic Circuits with Array Tomography
In the lab we apply a high-resolution fluorescence microscopy technique called Array Tomography (ATom). ATom allows quantitative interrogation about the spatial organization and fine architecture of synaptic circuits present in the nervous system. This approach enables to investigate very precisely how structural changes in neural circuits could contribute to the pathophysiology of mental illnesses.
- Patricia Gaspar (Institut du Cerveau et de la Moelle épinière, Francia)
- Flavia Saravia (IBYME-CONICET – FCEN, UBA, Argentina)
- Jacques Barik y Sebastián P. Fernández (Institut de Pharmacologie Moléculaire et Cellulaire – CNRS – Univ. Côte D’Azur, Francia)
- Marco Diana y Eric Schwartz (Saints-Pères Paris Institute for the Neurosciences – CNRS – Univ. Paris Cité, Francia)
- Frank J. Meye (Univ. Medical Center Utrecht, Países Bajos)
- Francisco J. Urbano y Paula Perissinotti (IFIBYNE – FCEN, UBA – CONICET, Argentina)
- Elena Avale (INGEBI – CONICET, Argentina)
FACAL C.L., FERNANDEZ BESSONE I., MUÑIZ J.A., PEREYRA A.E., PEDRONCINI O., PÁEZ-PAZ I., CLERICI-DELVILLE R., ARNAIZ C., URRUTIA L., FALASCO G., ARGAÑARAZ C.V., SAEZ T., MARIN-BURGIN A., SOIZA-REILLY M., FALZONE T., AVALE M.E.
Tau reduction with artificial microRNAs modulates neuronal physiology and improves tauopathy phenotypes in mice
MOL THER.; Lugar: Cambridge (USA); Año: 2024 vol. 32(4), p 1080 – 1095.
*ARGANARAZ, C.V., *ADJIMANN, T.S., PERISSINOTTI, P.P., SOIZA-REILLY, M.
Selective refinement of glutamate and GABA synapses on dorsal raphe 5-HT neurons during postnatal life
DEVELOPMENT; Lugar: Cambridge; Año: 2022 vol. 149(24) p. dev201121.
LINDERS, L.E., PATRIKIOU, L., SOIZA-REILLY, M., SCHUT, E.H.S., VAN SCHAFFELAAR, B.F., BÖGER, L., WOLTERINK-DONSELAAR, I.G., LUIJENDIJK, M.C.M., ADAN, R.A.H., MEYE, F.J.
NATURE COMMUNICATIONS; Lugar: Londres; Año: 2022 vol. 13(1) p. 6898.
SOIZA-REILLY, M.
Transcriptional preservation of serotonergic connectivity may shed light on neurodegeneration
TRENDS IN NEUROSCIENCES; Lugar: Cambridge, MA; Año: 2022 vol. 45(8) p. 563 – 565.
ROMERO DM; POIRIER K; BELVINDRAH R; MOUTKINE I; HOULLIER A; LE MOING AG; PETIT F; BOLAND A; COLLINS SC; SOIZA-REILLY M; YALCIN B; CHELLY J; DELEUZE JF; BAHI-BUISSON N; FRANCIS F
NATURE COMMUNICATIONS; Lugar: Londres; Año: 2022 vol. 13(1) p. 2746
DAMIANICH A; FACAL CL; MUÑIZ JA; MININNI C; SOIZA-REILLY M; PONCE DE LEÓN M; URRUTIA L; FALASCO G; FERRARIO JE; AVALE ME
Tau mis-splicing correlates with motor impairments and striatal dysfunction in a model of tauopathy
BRAIN; Lugar: Oxford; Año: 2021 vol. 144(8) p. 2302 – 2309
ADJIMANN TS*; ARGAÑARAZ CV*; SOIZA-REILLY M
TRANSLATIONAL PSYCHIATRY; Lugar: Londres; Año: 2021 vol. 11 p. 280
MUZERELLE A; SOIZA-REILLY M; HAINER C; RUET PL; LESCH KP; BADER M; ALENINA N; SCOTTO-LOMASSESE S; GASPAR P
SCIENTIFIC REPORTS; Lugar: Londres; Año: 2021 vol. 11 p. 6004
NUNO-PEREZ A; TRUSEL M; LALIVE AL; CONGIU M; GASTALDO D; TCHENIO A; LECCA S; SOIZA-REILLY M; BAGNI C; MAMELI M
NEURON; Lugar: Cambridge; Año: 2021 vol. 109 p. 947 – 956
OLUSAKIN J; MOUTKINE I; DUMAS S; PONIMASKIN E; PAIZANIS E; SOIZA-REILLY M*; GASPAR P*
NEUROPSYCHOPHARMACOLOGY; Lugar: Londres; Año: 2020 vol. 45 p. 2267 – 2277
SOIZA-REILLY M; MEYE FJ; OLUSAKIN J; TELLEY L; PETIT E; CHEN X; MAMELI M; JABAUDON D; SZE JY; GASPAR P
MOLECULAR PSYCHIATRY; Lugar: Londres; Año: 2019 vol. 24 p. 726 – 745
GARCIA-GARCIA AL*; SOIZA-REILLY M*
Serotonin Subsystems Modulate Diverse and Opposite Behavioral Functions
ACS Chemical Neuroscience; Lugar: Washington DC; Año: 2019 vol. 10 p. 3061 – 3063
FERNANDEZ, SEBASTIAN P.; BROUSSOT, LOÏC; MARTI, FABIO; CONTESSE, THOMAS; MOUSKA, XAVIER; SOIZA-REILLY M; MARIE, HÉLÈNE; FAURE, PHILIPPE; BARIK, JACQUES
NATURE COMMUNICATIONS; Lugar: Londres; Año: 2018 vol. 9(1) p. 4449
TEISSIER A*; SOIZA-REILLY M*; GASPAR P
Refining the role of 5-HT in postnatal development of brain circuits
Frontiers in Cellular Neuroscience; Lugar: Laussane; Año: 2017 vol.11 p.139
MEYE FJ; SOIZA-REILLY M; SMIT T; DIANA MA; SCHWARZ M; MAMELI M
Shifted pallidal GABA/Glutamate corelease in habenula drives cocaine withdrawal and relapse
NATURE NEUROSCIENCE.; Lugar: Londres; Año: 2016 vol. 19(8) p. 1019 – 1024
MUZERELLE A; SCOTTO-LOMASSESE S; BERNARD JF; SOIZA-REILLY M; GASPAR P
BRAIN STRUCTURE & FUNCTION; Lugar: HEIDELBERG; Año: 2016 vol. 221 p. 535 – 561
SOIZA-REILLY M; GOODFELLOW NM; LAMBE EK; COMMONS KG
Enhanced 5-HT1A receptor-dependent feedback control over dorsal raphe serotonin neurons in the SERT knockout mouse
NEUROPHARMACOLOGY; Lugar: Amsterdam; Año: 2015 vol. 89 p. 185 – 192
SOIZA-REILLY M*; COMMONS KG*
Unraveling the architecture of the dorsal raphe synaptic neuropil using high-resolution neuroanatomy
Frontiers in Neural Circuits; Lugar: Lausanne; Año: 2014 vol. 8 p. 1 – 7
SOIZA-REILLY M; ANDERSON WB; VAUGHAN CW; COMMONS KG
Presynaptic gating of excitation in the dorsal raphe nucleus by GABA
PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA; Lugar: Washington DC, USA; Año: 2013 vol. 110 p. 15800 – 15805
SOIZA-REILLY M; COMMONS KG
Glutamatergic drive of the dorsal raphe nucleus
JOURNAL OF CHEMICAL NEUROANATOMY.; Lugar: Amsterdam; Año: 2011 vol. 41 p. 247 – 255
SOIZA-REILLY M*; COMMONS KG
JOURNAL OF COMPARATIVE NEUROLOGY; Lugar: New York; Año: 2011 vol. 519 p. 3802 – 3814
SOIZA-REILLY M; AZCURRA JM
Developmental striatal critical period of activity-dependent plasticity is also a window of susceptibility for haloperidol induced adult motor alterations
NEUROTOXICOLOGY AND TERATOLOGY.; Lugar: Amsterdam; Año: 2009 vol. 31 p. 191 – 197
SOIZA-REILLY M; FOSSATI M; IBARRA GR; AZCURRA JM
Different dopamine D1 and D2 receptors expression after motor activity in the striatal critical period
BRAIN RESEARCH; Lugar: Amsterdam; Año: 2004 vol. 1004 p. 217 – 22
- CZI Grant Advancing Imaging Through Collaborative Projects: Array tomography Training and Network, Chan Zuckerberg Initiative, EEUU.
- Subsidio ECOS-Sud 2022, Ministerio de Ciencia, Tecnología e Innovación, Argentina – Ministère de l’Enseignement Supérieur et de la Recherche, Francia.
- Subsidio para la Investigación en Cs. Biomédicas 2022, Fundación Florencio Fiorini – Academia Nacional de Medicina.
- Subsidio PIP-2021-2023, CONICET.
- Subsidio PICT-2019 D, Agencia I+D+i.
- 2019 Young IBRO Connecting Award, IBRO.
- 2018 Return Home Grant, International Society for Neurochemistry.
- 2017 IBRO Return Home Award.
Lab meeting at The Node – The Company of Biologists
Lab meeting with the Soiza-Reilly lab
Emociones: de roedores a humanos.
A Todo Neuro, Podcast de la Sociedad Argentina de Investigación en Neurociencias
Niños estresados, ¿adultos vulnerables?
por Magalí de Diego (CTyS-UNLaM)
Investigan cómo impacta sufrir estrés durante la infancia
por Magalí de Diego (CTyS-UNLaM)
por Bruno Geller (CONICET)
The people behind the papers – Carla Argañaraz, Tamara Adjimann and Mariano Soiza-Reilly
por la revista DEVELOPMENT
Integrantes del grupo / Team members

Tamara Adjimann
Becaria Doctoral CONICET

Tamara Adjimann
Becaria Doctoral CONICET

Grace Wu
Estudiante de Lic.

Grace Wu
Estudiante de Lic.

Rocío Foltran
Becaria Postdoctoral CONICET


Carla Argañaraz
Becaria Doctoral CONICET

Carla Argañaraz
Becaria Doctoral CONICET
- Phone:+549 (11) 4576-3368 (int. 332)
- Email:carlu.arg@gmail.com

Melina Maidana
Estudiante de Lic.

Melina Maidana
Estudiante de Lic.