Blancos terapéuticos y microambiente en cáncer de mama /Therapeutic targets & microenvironment in breast cancer
Dra. Albana Gattelli
JEFA DE GRUPO /GROUP LEADER
Editorial Board PLOS Biology
Investigadora Adjunta CONICET
Resumen/Summary
Entender la fisiología de un órgano y su contexto nos ayuda a comprender los procesos patológicos que operan en el cáncer. Mi grupo de investigación estudia varios de los mecanismos que gobiernan la interacción entre la célula tumoral y el microambiente de la glándula mamaria. Por un lado, en el laboratorio nos centramos en proyectos que estudian un tipo particular de receptores denominados tirosina quinasa o RTKs (RET y VEGFR, entre otros), su valor pronóstico y su potencial como blanco de terapia dirigida en cáncer de mama. Nos focalizamos en entender la relación entre estos receptores en la célula tumoral mamaria y células específicas del microambiente, como por ejemplo los adipocitos o el sistema vascular. Por otro lado, llevamos a cabo un proyecto que tiene como objetivo revelar nuevos blancos que sienten las bases de estrategias terapéuticas novedosas para combatir el cáncer de mama. Para abordar estos temas utilizamos tanto modelos animales, como por ejemplo ratones transgénicos especialmente diseñados, como modelos celulares en cultivo. Para estudiar y validar los mecanismos involucrados utilizamos técnicas de biología molecular y celular básica y de nueva generación, entre ellas, edición génica por CRISPR/Cas9 y el diseño de screenings funcionales. Confío en que una sólida investigación básica y pre-clínica en cáncer de mama abrirá caminos alternativos para resolver problemas clínicos relevantes.
Understanding the physiology of an organ and its context helps us comprehend the pathological processes that operate in cancer. My research group studies several mechanisms that govern the interaction between tumor cells and the microenvironment of the mammary gland. In one side, in the laboratory, we focus on projects that investigate a particular type of receptors known as tyrosine kinases (such as RET and VEGFR, among others), their prognostic value, and their potential as targets for targeted therapy in breast cancer. We aim to understand the relationship between these receptors in breast tumor cells and specific microenvironmental cells, such as adipocytes or the vascular system. On the other hand, we are conducting a project aimed at revealing new targets that lay the groundwork for novel therapeutic strategies to combat breast cancer. To address these topics, we utilize both animal models, such as specially designed transgenic mice, and cell culture models. To study and validate the involved mechanisms, we employ basic and next-generation molecular and celuar biology techniques, including CRISPR/Cas9 gene editing and the design of functional screenings. I believe that solid basic and preclinical research in breast cancer will pave the way for alternative solutions to relevant clinical problems.
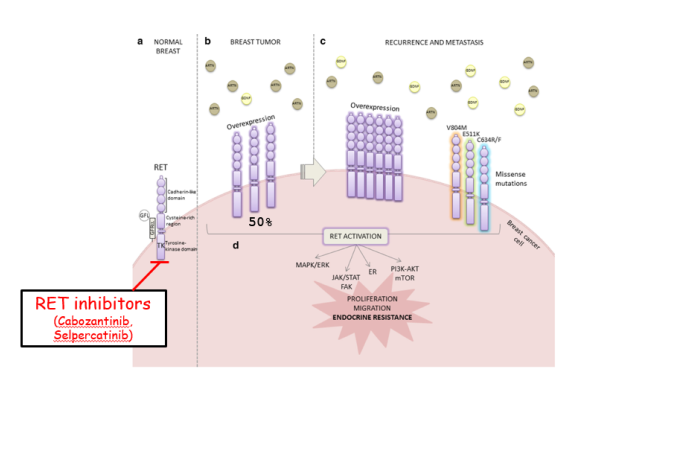
En el órgano mamario, los adipocitos son las células especializadas en el almacenamiento de lípidos que constituyen el principal componente celular del microambiente. En el cáncer, el tejido adiposo adyacente al tumor de mama está compuesto por adipocitos modificados. Comprender la interacción entre ambos tipos de células podría guiar nuevas terapias para tratar los tumores de mama. En esta línea de investigación, introducimos al receptor tirosina quinasa (RTK) RET como un regulador de la interacción entre el tumor mamario y el tejido adiposo.
RET ha sido identificado como un objetivo terapéutico sobre-expresado en el 40% de los tumores de mama, y niveles elevados de RET se correlacionan con una disminución de la supervivencia en los pacientes. En los últimos años, utilizando un sistema murino inducible por antibiótico (RET/MTB), hemos demostrado por primera vez que la expresión crónica de RET es oncogénica en la glándula mamaria (Gattelli et al., Oncogene, 2018). Además, hemos revelado la importancia de RET como biomarcador de riesgo de cáncer de mama en el post-lactancia (Vallone et al., DMM, 2022). Los estudios actuales están respaldados por resultados preliminares sólidos producidos en IFIBYNE, que muestran que el receptor RET en la célula tumoral modula la maduración del adipocito mamario a favor de la progresión tumoral. Estas investigaciones incluyen tanto el uso de modelos bicelulares in vivo como cultivos de diferenciación de adipocitos in vitro. En este sentido, la colaboración internacional con el Dr. Sabio (CNIO, España) es fundamental. Basándonos en esta colaboración, planeamos diseñar un modelo murino de trazado de linaje de vanguardia que nos permitirá seguir el destino de los adipocitos mamarios en el contexto de tumores mamarios RET+.
In the breast organ, adipocytes are the specialized cells for lipids storage that make up the major cellular component of the microenvironment. In cancer, the adipose tissue adjacent to the breast tumor consists of modified adipocytes Understanding the interaction between both cell types could guide novel therapies to treat breast tumors. In this research line we introduce the receptor tyrosine kinase (RTK) named RET as a regulator of breast tumor-adipose tissue interplay.
RET has been identified as a therapeutic target overexpressed in 40% of breast tumors, and high RET levels correlate with decreased survival in patients. In the last years, using a doxycycline-inducible mouse system (RET/MTB), we have demonstrated for first time that chronic expression of non- mutated RET is oncogenic in the mammary gland (Gattelli et al, Oncogene, 2018). Furthermore, we could reveal the importance of RET as biomarker of breast cancer risk in post-lactation (Vallone et al, DMM, 2022). Current studies are supported by strong preliminary data produced in IFIBYNE showing that RET receptor in the tumor cell modulates the maturation of breast adipocyte in favor of tumor progression. These investigations involve both the use of in vivo bicellular models and in vitro adipocyte differentiation cultures. Herein the international collaboration with Dr. Sabio (CNIO, Spain) it is fundamental. Based in this collaboration, we will plan to design a cutting-edge lineage tracing mouse model that will enable us to trace mammary adipocytes fate in the context of RET+ mammary tumors.
Varios receptores tirosina quinasa (RTK) han estado involucrados en la resistencia terapéutica; por ejemplo, el receptor RET está elevado en tumores mamarios resistentes al tratamiento hormonal (Gattelli et al., JOMG, 2020). Así, se han diseñado compuestos para bloquear selectivamente la actividad de ciertos RTKs, aunque algunos de ellos han tenido éxito limitado a largo plazo. En esta línea de investigación, buscamos nuevas combinaciones de fármacos para mejorar la respuesta al tratamiento con inhibidores de RTK, particularmente los inhibidores de VEGFR (conocidos por bloquear la formación de vasos sanguíneos). Desde entonces, iniciamos una colaboración con el Dr. Schere-Levy, fusionando nuestro conocimiento en diferentes vías de señalización: RTK y el sistema renina-angiotensina (RAS). Estamos evaluando los beneficios del tratamiento con angiotensina-(1-7), un componente de RAS, en varios modelos de cáncer (Schere-Levy et al., IJMS, 2022), incluyendo actualmente el cáncer de mama. Mantenemos una colaboración fructífera con el Dr. Walther (Xitra Therapeutics, Alemania), un experto en este campo. Además, utilizamos diferentes sistemas moleculares en cultivos celulares para abordar los mecanismos involucrados.
Several receptor tyrosine kinases (RTKs) have been involved in therapeutic resistance; for example, RET receptor is elevated in mammary tumors resistant to hormonal treatment (Gattelli et al, JOMG, 2020). Thus, compounds have been designed to selectively block the activity of certain RTKs but, some of them have limited success in long term. In this research line we search for new drug combination to improve response to the treatment of inhibition of RTKs, particularly to VEGFR inhibitors (known to block vasculature formation). Since then, we initiated a collaboration with Dr. Schere-Levy merging our knowledge in different signaling pathways: RTKs and the renin-angiotensin system (RAS). We are evaluating the benefits of treatment with angiotensin-(1-7), a component of RAS, in several cancer models (Schere-Levy et al, IJMS, 2022), currently including breast cancer. Together with Dr. Schere-Levy we keep a fruitful collaboration with Dr. Walther (Xitra Therapeutics, Germany), an expert in this field. In addition, we use different molecular systems in cell culture to address the mechanisms involved.
Esta línea de investigación constituye un enfoque no sesgado o unbiased que surge de un proyecto multidisciplinario en colaboración con investigadores locales, el Dr. Fededa (IIB-UNSAM), el Dr. Carrera-Silva (Academia Nacional de Medicina), el Dr. de la Mata (IFIBYNE-UBA), y la Dra. Kordon (IFIBYNE-UBA). Hemos generado y caracterizado en profundidad un novedoso modelo tumoral inmunodeficiente que será utilizado posteriormente en un screening in vivo basado en CRISPR/Cas9. En dicho modelo, editamos el PD-L1 tumoral, una molécula terapéutica actual que participa en la evasión del sistema inmune por parte de la célula tumoral, desencadenando cambios en una población específica de células mieloides. Al realizar el screening, esperamos encontrar potenciales blancos terapéuticos bajo una condición específica de inmunodeficiencia, la pérdida de PD-L1 intrínseca al tumor. Como alternativa al enfoque de screening genómico completo, se podrán realizar screenings más pequeños y dirigidos. Por lo tanto, la búsqueda puede enfocarse en genes agrupados por vías de señalización específicas y/o en RTKs, no solo por nuestra experiencia en este tipo de receptores, sino también porque son excelentes proteínas para ser blanco de terapias. Dependiendo de nuestros candidatos y su validación, este proyecto abrirá, sin lugar a dudas, líneas futuras de investigación.
This research line constitutes an unbiased approach that arises from a multidisciplinary project in collaboration with Argentinian researchers from different institutions: Dr. Fededa (IIB-UNSAM), Dr. Carrera-Silva (Academia Nacional de Medicina), Dr. de la Mata (IFIBYNE-UBA) and Dra. Kordon (IFIBYNE). We have already generated and fully characterized a novel immunodeficient mammary tumor model that will be subsequently used in an in vivo CRISPR/Cas9-based screening. In that model, we ablate tumoral PD-L1, a central molecule that drive the evasion of the immune system by tumor cell, triggering changes in a specific myeloid cell population (manuscript in preparation). Performing the screen, we expect to find potential therapeutic targets under a specific immunodeficiency condition, tumor-intrinsic PD-L1 loss. For instance, smaller targeted screens are being designed as an alternative to the genome-wide screening approach. Thus, the platform screen could be focused on genes grouped by pathway signatures and/or on RTKs, not only for our expertise on those type of receptors, but because there are excellent proteins to target. Depending on our candidates and validation, this project is opening without a doubt future research lines.
Publicaciones/Publications
Publicaciones relevantes seleccionadas (10)/Selected relevant publications (10)
- SA. Vallone, M. García Solá, C. Shere-Levy, RP. Meiss, GN. Hermida, LA. Chodosh, EC. Kordon, NE. Hynes, A. Gattelli*. Aberrant Ret expression affects normal mammary gland post-lactation transition, enhancing cancer potential. *Corresponding author. Disease Models & Mechanisms, 15(3):dmm049286, 2022.
- A. Gattelli, NE. Hynes, I. Schor and SA. Vallone. Ret receptor has distinct alterations and functions in breast cancer. Journal of Mammary Gland Biology and Neoplasia, 25(1):13-26, 2020.
- A. Gattelli*, M. García Solá, TC. Roloff, RD. Cardiff, EC. Kordon, LA. Chodosh, NE. Hynes*. Chronic expression of wild type Ret receptor in the mammary gland induces tumors that are sensitive to Ret inhibition. *Corresponding author. Oncogene, 37(29):4046-4054, 2018.
- A.Bottos, D.Gotthardt, J.W.Gill, A. Gattelli, A.Frei, A.Tzankov, V. Sexl, A.Wodnar-Filipowicz, N.E. Hynes. Decreased NK cell tumor immunosurveillance consequent to JAK inhibition enhances metastasis in breast cancer models. Nature Communications, 7:12258, 2016.
- A. Gattelli, I. Nalvarte, A. Boulay, TC. Roloff, M. Schreiber, N. Carragher, KK. Macleod, M. Schlederer, S. Lienhard, L. Kenner, MI. Torres-Arzayus and NE. Hynes. Ret inhibition decreases growth and metastatic potential of estrogen receptor positive breast cancer cells. EMBO Molecular Medicine, 5(9):1335-1350, 2013.
- MV. Goddio, A.Gattelli, V. Slomiansky, E. Lacunza, T. Gingerich, J. Tocci, NM. Facchinetti, A. Curino, J. LaMarre, MC. Abba and EC. Kordon. Mammary differentiation induces expression of Tristetraprolin, a tumor suppressor AU-rich mRNA-binding protein. Breast Cancer Research and Treatment, 135(3):749-758, 2012.
- NE. Hynes and A. Gattelli. P-Rex1, a guanine exchange factor that is overexpressed in breast cancer, is a convergence node for ErbB and CXCR4 signaling. Molecular Cell, 41(1):5-7, 2011.
- A. Gattelli, MN. Zimberlin, RP. Meiss, LH. Castilla, EC. Kordon. Selection of early-occurring mutations dictates hormone-independent progression in mouse mammary tumor lines. Journal of Virology, 80(22):11409-11415, 2006.
- A. Gattelli, MC. Cirio, A. Quaglino, C. Shere-levy, N. Martinez, M. Binaghi, RP. Meiss, LH. Castilla, EC. Kordon. Progression of pregnancy-dependent mouse mammary tumors after long dormancy periods. Involvement of Wnt pathway activation. Cancer Research, 64: 5193-5199, 2004.
- V. Buggiano*, C. Shere-Levy*, A. Gattelli*, MC. Cirio, Mariana Marfil, I. Nepomnaschy, I. Piazzon, L. Helguero, S. Vanzulli, EC. Kordon. Origin and progression of pregnancy-dependent mammary tumors induced by new mouse mammary tumor virus variants. Breast Cancer Research and Treatment, 75(3):191-202, 2002. *These authors equally contributed to this paper.
Subsidios/Research support
Financiamiento actual/Ongoing research support
2023-2024 Argentinian Research Grant “Investigación en Ciencias Biomédicas” from “Fundación Florencio Fiorini (FFF)”, Buenos Aires, Argentina. Role: Principal Investigator.
2022-2025 Argentinian Research Grant “Proyectos de Investigación Plurianuales (PIP)” del Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET), Buenos Aires, Argentina. KB1 11220200102235CO. Role: Co-Principal Investigator.
2021-2024 Argentinian Research Grant “Proyectos de Investigación Científica y Tecnológica (PICT)” from “Agencia Nacional de Producción Científica y Tecnológica (ANPCyT)”, Buenos Aires, Argentina. PICT-2019-02850. Role: Principal Investigator.
Fianciamiento previo/Completed Research Support
2018-2021 Argentina/UK Research Grant “Proyectos concertados con empresas PCE-GSK” from GlaxoSmithKline (GSK) and “ANPCyT”, Buenos Aires, Argentina. PCE-2017-0052. Role: Co-Principal Investigator. (extended 2023).
2018-2021 Argentinian Research Grant “PICT” from “ANPCyT”, Buenos Aires, Argentina. PICT-2016-1268. Role: Principal Investigator.
2017-2019 Argentinian Research Grant “Programa de Estímulo a la Investigación en Ciencias Biomédicas 2017” from “Fundación para el Progreso de la Medicina” (fpm), Córdoba, Argentina. GF Nº02. Role: Principal Investigator.
2017-2020 Argentinian Research Grant “PICT” from “ANPCyT”, Buenos Aires, Argentina. PICT-2016-2834. Role: Co-Principal Investigator.
2017-2019 Argentinian Research Grant “UBACyT” from UBA, Buenos Aires, Argentina. 20020160100087BA. Role: Collaborador.
2016-2018 Argentinian Research Grant “PICT” from “ANPCyT”, Buenos Aires, Argentina. PICT-2014-0844. Role: Collaborador.
2013-2014 Research Postdoctoral Grant from “Krebsliga beider Basel” Basel, Switzerland.10-2030. Role: Postdoctoral Fellow.
2010-2013 Postdoctoral Fellowship Research Grant from “Susan G. Komen for the Cure”, USA. KG101234. Role: Postdoctoral Fellow.
Noticias/Medios/News
Video UBATEC
https://www.instagram.com/p/CyTwJN3t6v5/
Newsletter UBATEC
https://x.com/UbatecSA/status/1715057934692999271
TVP interview
Directora de Proyecto / Investigator
Group members

Lic. Sabrina Vallone - CONICET
Student Wood-Whelan & COB Fellow

Lic. Sabrina Vallone - CONICET
Student Wood-Whelan & COB Fellow
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Lic. Agustina Carnevale - CONICET
PhD. Student DAAD Fellow

Lic. Agustina Carnevale - CONICET
PhD. Student DAAD Fellow
- Email:acarnevale116@gmail.com

Dra. Angela Lara
Becaria Postdoctoral/Postdoc

Dra. Angela Lara
Becaria Postdoctoral/Postdoc
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Clara de los Santos
Estudiante/Master student

Clara de los Santos
Estudiante/Master student
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Paula D. Ienni
Estudiante/Master student

Paula D. Ienni
Estudiante/Master student
- Phone:+549 (11) 2546-6589
- Email:info@example.com
Miembros anteriores/Former group members

Dr. Marcos Palavecino
Becario Postdoctoral

1
2