Tema de Investigación:
Nuestro trabajo, en términos generales, se enmarca en el estudio del proceso de la exocitosis regulada de hormonas y neutransmisores, como ocurre en células neuroendócrinas y neuronas. Utilizamos como modelo experimental a las células cromafines de la médula adrenal. Este proceso es disparado por un aumento del Ca2+ citosólico en un dominio próximo a la membrana plasmática, generado por activación de canales voltaje dependientes. El papel del Ca2+ en el proceso secretorio no se limita a activar la fusión de los gránulos, ya que también participaría regulando otras etapas como la translocación entre diferentes “pools” vesiculares y la endocitosis. Las células neuroendocrinas poseen varias fuentes posibles de Ca2+: diferentes canales de Ca2+ (L, N, P/Q), y liberación de Ca2+ desde el retículo endoplasmático por receptores de rianodina y/o inositol trifosfato (IP3). A lo largo de los años, nos venimos concentrando en varios aspectos de este proceso: (1) el acoplamiento de las diferentes fuentes de Ca2+ con la exocitosis, particularmente de vesículas secretorias altamente acopladas con el estímulo; (2) los procesos de endocitosis asociados, y su acople con la exocitosis previa; (3) el reciclado de los “pools” liberables de vesículas y su relación con la vía endocítica utilizada; (4) los procesos de generación, transporte y maduración vesicular. Se utilizan células cromafines en cultivo de ratón y vaca. Las técnicas aplicadas son: (a) “Patch-clamp” en configuración “whole-cell” para la medición de corrientes y de la exocitosis por medio del registro de la capacitancia. (b) La exocitosis se mide además independientemente por la técnica de amperometría, la cual permite a su vez evaluar la cinética de formación del poro de fusión, su dinámica, y el colapso completo de la vesícula en la membrana. (c) Para la medición de procesos de generación, transporte y maduración vesicular se utilizan técnicas de imágenes de microscopía de fluorescencia convencional y confocal, con la utilización de diversas sondas fluorescentes. (d) Las señales de Ca2+ que acompañan los procesos en estudio pueden ser registradas con el uso de indicadores de Ca2+ fluorescentes.
Exocitosis del “pool” de vesículas inmediatamente liberable (IRP): desde hace más de 20 años venimos estudiando las características de este grupo de vesículas, que se caracteriza por exocitarse muy velozmente debido a que se encuentra altamente acoplado a la activación de canales de calcio voltaje dependientes, en forma similar a lo que ocurre en terminales presinápticas. Entre diversos aspectos que investigamos, demostramos su asociación específica con canales de calcio de tipo P/Q, y que dicha asociación se realiza a través de la secuencia synprint del canal. También demostramos que una fracción de su exocitosis se puede efectuar de forma independiente de la entrada de calcio por los canales P/Q, y dependiente sólo de la activación eléctrica de estos. Encontramos también que dentro de IRP se encuentra una pequeña fracción de vesículas que es exocitada específicamente por la aplicación de un potencial de acción o trenes de potenciales de acción a a frecuencias menores a 0.5 Hz. Dicha fracción, a la cual llamamos ETAP, por “exocytosis triggered by action potential” posee características especiales respecto a la endocitosis acoplada a su exocitosis, y a un rápido proceso de recuperación asociado.
Endocitosis y recuperación vesicular ligados a la exocitosis de IRP:
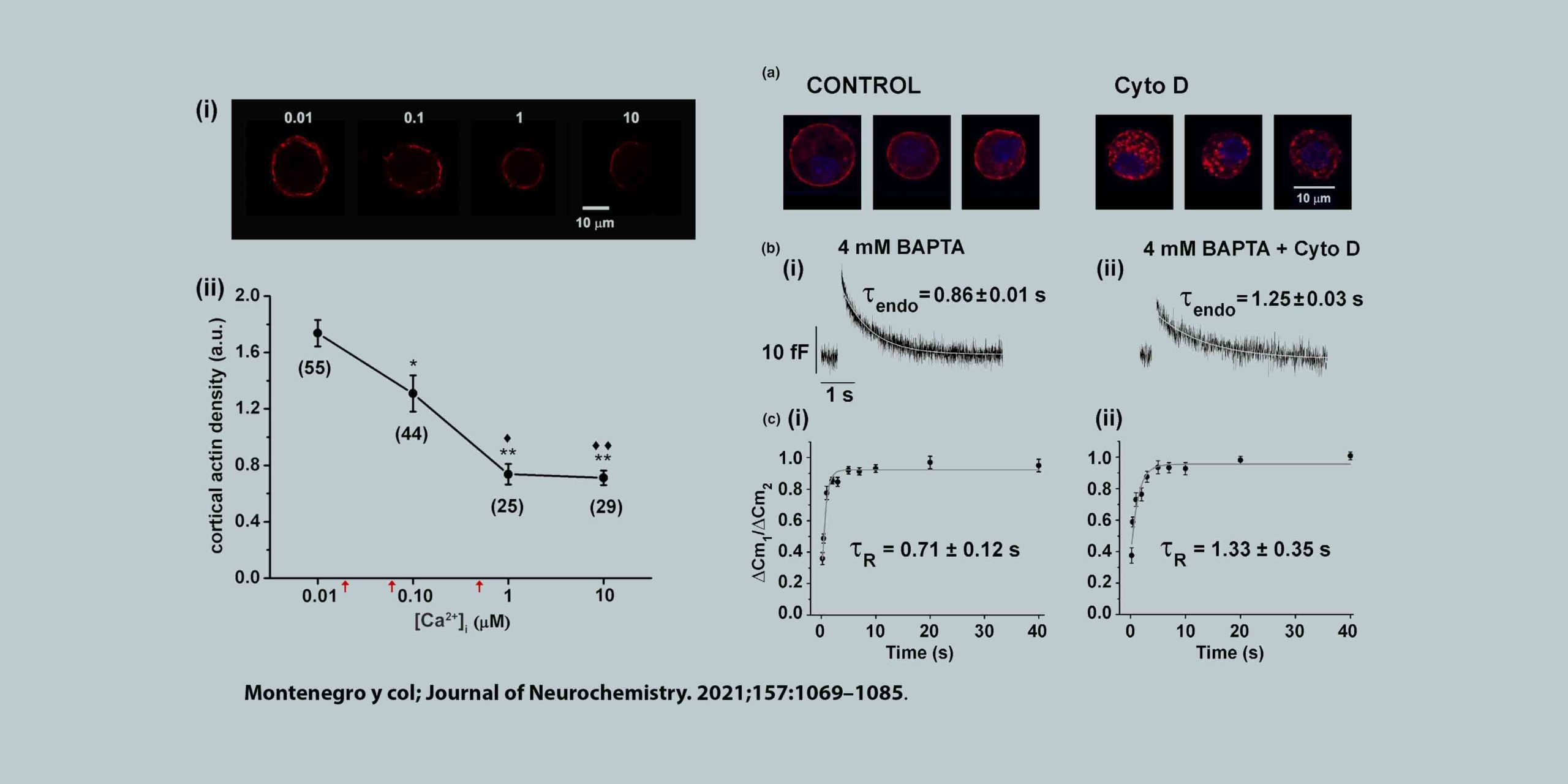
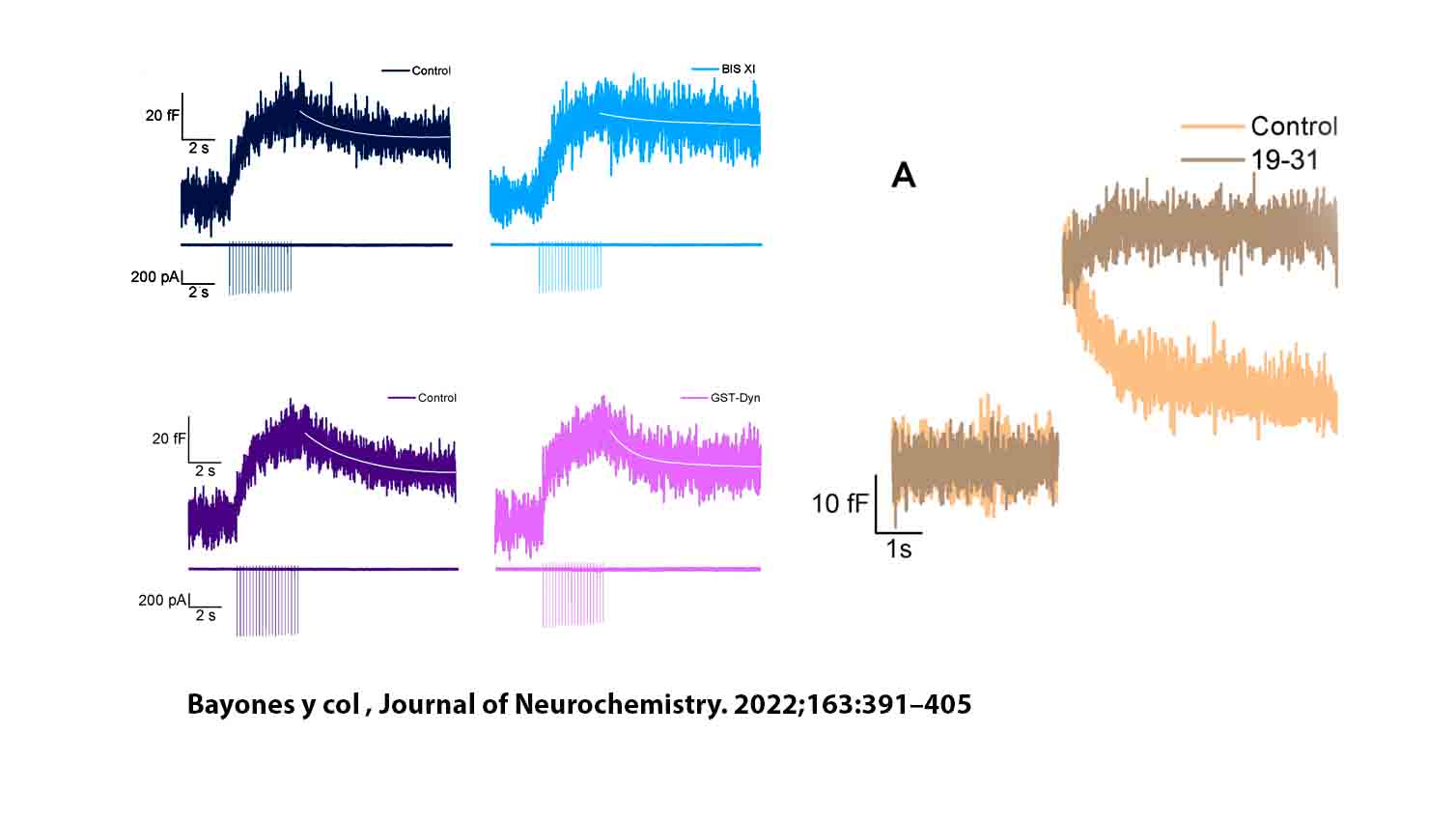
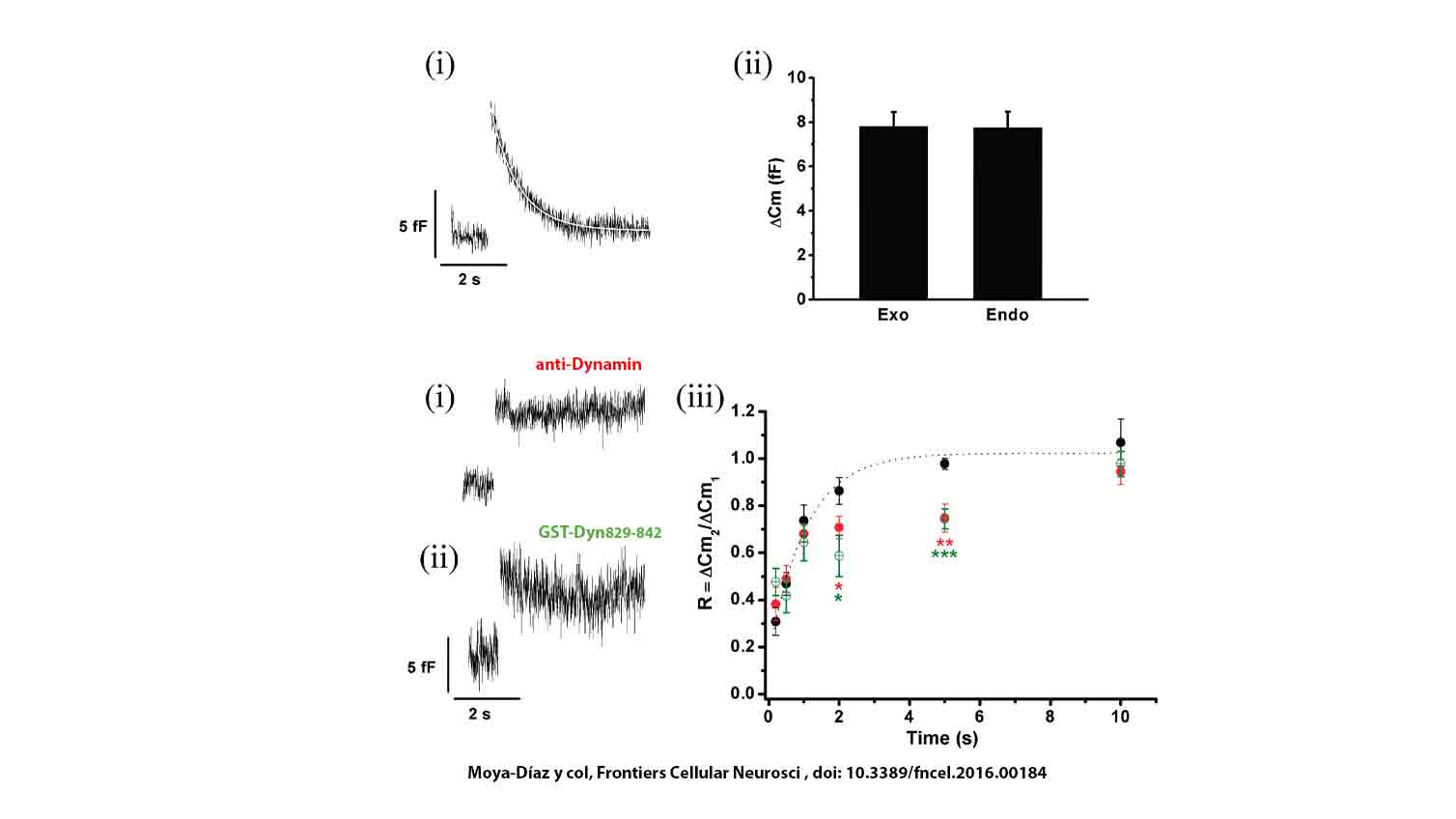
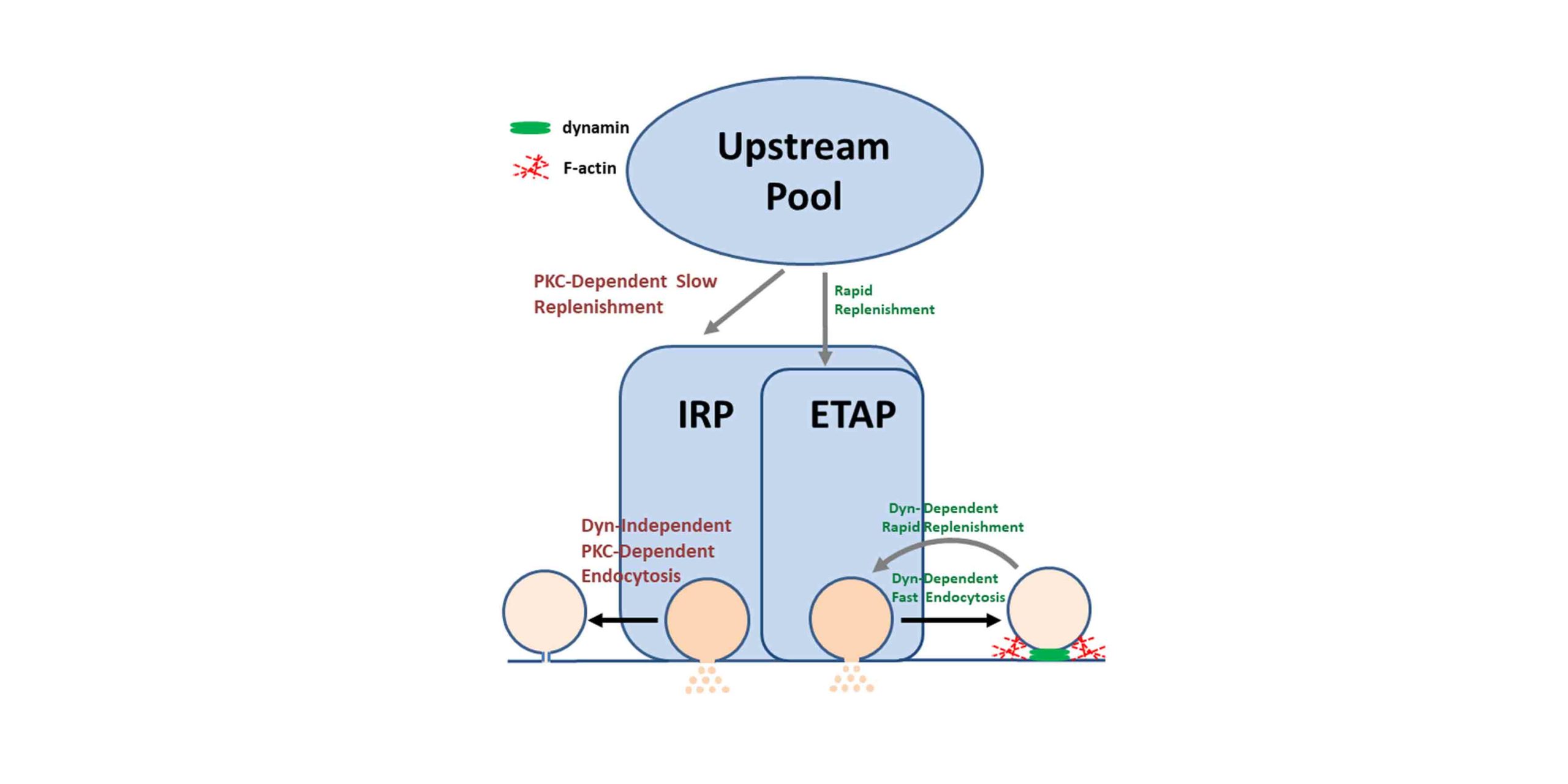
En una serie de trabajos que venimos publicando desde el año 2016 demostramos que en forma inmediatamente posterior a la exocitosis de ETAP se activa una endocitosis rápida, con una constante temporal de 0.5-1 segundo, que normalmente restituye la superficie de membrana en forma completa, es decir que es una endocitosis compensatoria. Dicha endocitosis es altamente dependiente de la acción de la GTPasa dinamina de F-actina, aunque se inhibe en presencia de una concentración alta de calcio citosólico, y parecería ser independiente de clatrina. Muy recientemente, demostramos además que frente a la exocitosis de fracciones mayores de IRP se activa un segundo mecanismo de endocitosis que suplanta al primero, siendo este dinamina-independiente pero dependiente de proteína quinasa C. Mientras que el mecanismo dinamina-dependiente se inhibe a entradas mayores de calcio a la célula, este mecanismo dinamina-independiente/PKC-dependiente se activa.
Nuestros resultados muestran que dichos procesos endocíticos están fuertemente ligados a rutas de recuperación vesicular que parecen independientes. Mientras que la endocitosis dinamina-dependiente se asocia a un proceso de recuperación vesículas de IRP sumamente rápido (el más rápido descripto hasta el momento en células neuroendócrinas), con una constante temporal inferior al segundo, la endocitosis dinamina-independiente/PKC-dependiente está acoplada a una recuperación más lenta, con una constante temporal de alrededor de 7 segundos.
Estos resultados presentan un panorama bastante completo de cómo se recicla IRP. Una consecuencia interesante de importancia fisiológica, es que frente a una estimulación con potenciales de acción a frecuencias menores a 0.5 Hz (que representan las frecuencias basales de células cromafines) la endocitosis restituye completamente la superficie de membrana y exocitosis se recupera totalmente (al 100%) entre estímulo y estímulo. Debido a esto postulamos que la endocitosis dinamina-dependiente y la recuperación asociada son responsables del mantenimiento de la exocitosis de adrenalina desde la médula adrenal durante el reposo.
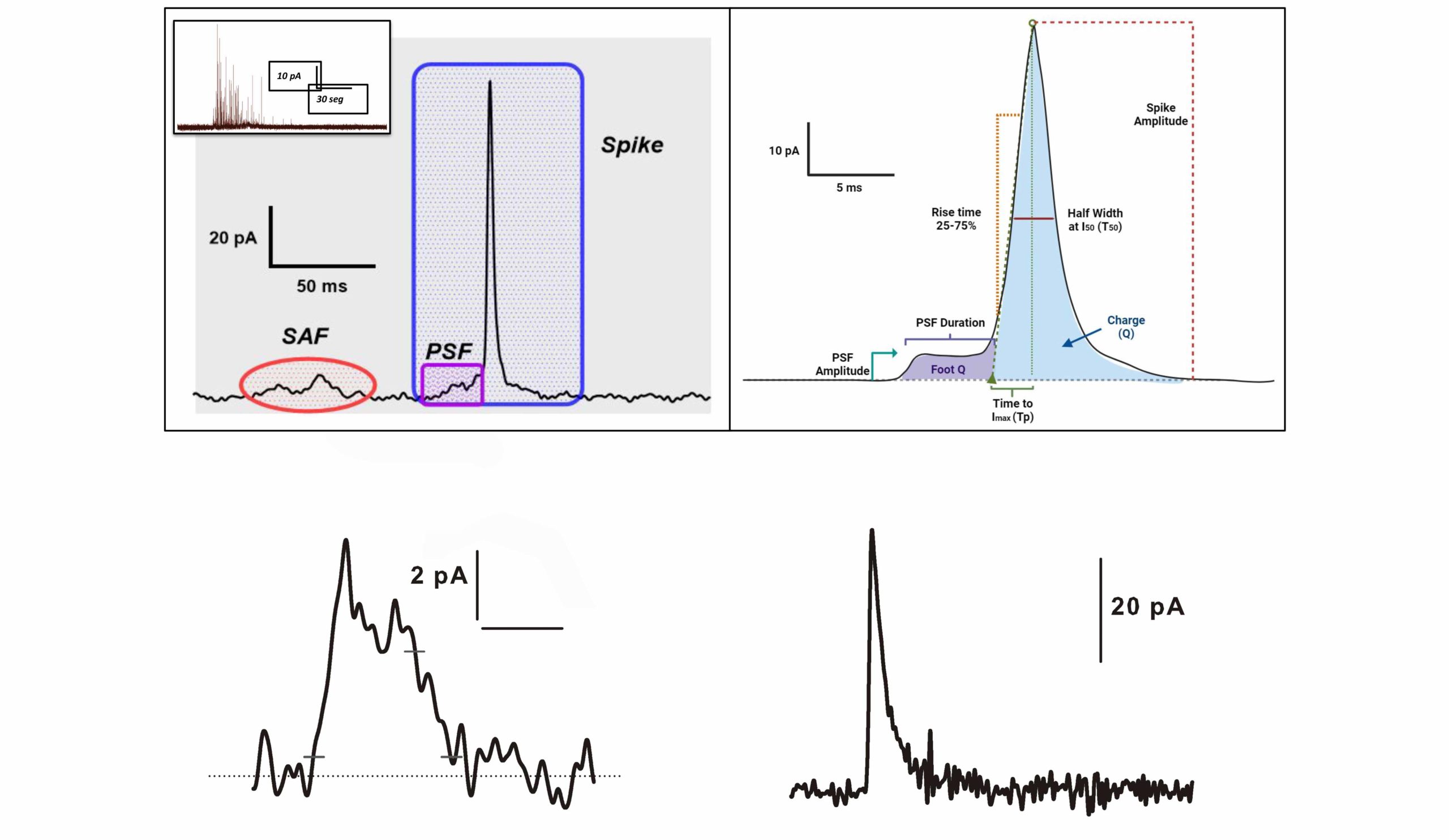
Regulación del poro de fusión vesicular, y sus efectos sobre la exocitosis y la endocitosis:
Desde 2022 hemos comenzado a investigar el efecto de diferentes proteínas vesiculares y citosólicas sobre la dinámica del poro de fusión, la exocitosis y la endocitosis. En este proyecto usamos la técnica de “patch-clamp” para el seguimiento de corrientes de calcio, exocitosis y endocitosis, y la amperometría para la detección de la secreción de adrenalina asociada a cada evento exocítico. Esta última técnica es capaz de resolver la evolución temporal de la liberación de adrenalina durante las diferentes etapas de un evento de exocitosis. El poro de fusión es un canal lipídico-proteico que se forma entre la vesícula secretoria (o sináptica) y la membrana plasmática durante la fusión de una vesícula. Inicialmente se forma un poro de fusión temprano que permite la liberación de una pequeña cantidad de catecolaminas, y que se detecta como un “foot” previo a la espiga amperométrica. Luego este poro se expande dando lugar a la liberación de todo o una fracción mayor del contenido vesicular y consecuentemente de la espiga amperométrica. La velocidad de subida y la duración media de dicha espiga nos habla del grado y el tiempo de apertura de dicho poro tardío, que puede llegar hasta un colapso completo. Por otro lado, el área bajo la espiga nos habla de la cantidad total de catecolaminas liberadas. Al momento estamos estudiando el efecto de diferentes variantes de sinaptotagminas y de una quimera Rab3a-Rab22a, de las cuales hay evidencias de que pueden modular al poro de fusión. Suponemos que dicha modulación puede tener efectos sobre la endocitosis, la recuperación vesicular y la respuesta secretoria de las células cromafines frente a una estimulación repetitiva.
- Lucas Bayonés, Mauricio Montenegro, José Moya-Díaz, Samuel Alfonso-Bueno, Luciana I. Gallo, y Fernando D. Marengo. Membrane Retrieval after Immediately Releasable Pool (IRP) Exocytosis is produced by Dynamin-Dependent and Dynamin-Independent Mechanisms. Journal of Neurochemistry. 2022;163:391–405. DOI: 10.1111/jnc.15710.
- Lucas Bayonés, María José Guerra-Fernández, Fernando Hinostroza, Ximena Báez-Matus, Jacqueline Vásquez-Navarrete, Luciana I. Gallo, Sergio Parra, Agustín D. Martínez, Arlek González-Jamett, Fernando D. Marengo*, y Ana M. Cárdenas*. Gain-of-Function Dynamin-2 Mutations Linked to Centronuclear Myopathy Impair Ca2+-Induced Exocytosis in Human Myoblasts. International Journal of Molecular Sciences, 2022, 23, 10363. https://doi.org/10.3390/ijms231810363. *estos dos autores son corresponding authors del trabajo.
Mauricio Montenegro, Lucas Bayonés, José Moya‐Díaz, Cecilia Borassi, Andrés Martín Toscani, Luciana I. Gallo, Fernando D. Marengo. Rapid vesicle replenishment after the immediately releasable pool exocytosis is tightly linked to fast endocytosis, and depends on basal calcium and cortical actin in chromaffin cells. Journal of Neurochemistry, 157:1069–1085, 2021. DOI: 10.1111/jnc.15276
José Moya-Díaz, Lucas Bayonés, Ana María Cárdenas, Henner Koch, Atsushi Doi, Mauricio Montenegro y Fernando D Marengo. Ca2+-Independent and Voltage-Dependent Exocytosis in mouse chromaffin cells. Acta Physiologica (Oxford). (ex Acta Physiologica Scandinavica). 2020; 00:e13417. https://doi.org/10.1111/apha.13417.
Fernando D. Marengo y Ana María Cárdenas. How does the stimulus define exocytosis in adrenal chromaffin cells? Pflugers Archive. Eur J Physiol. 470: 155-167. 2017.
José Moya Díaz, Yanina D. Álvarez, Mauricio Montenegro, Lucas Bayonés, Ana Verónica Belingheri, Arlek M. González-Jammet, Ana María Cárdenas y Fernando D. Marengo. Sustained Exocytosis After Action Potential-like Stimulation in Mouse Chromaffin Cells Depends on a Dynamin-dependent Fast Endocytotic Process. Frontiers in Cellular Neuroscience. 10:184. doi:10.3389/fncel.2016.00184, 2016.
Ana María Cárdenas y Fernando Marengo. How the Stimulus Defines the Dynamics of Vesicle Pool Recruitment, Fusion Mode and Vesicle Recycling in Neuroendocrine Cells. Journal of Neurochemistry 137: 867-879, 2016.
Yanina D. Álvarez, Andrés Pérez Bay, Ana V. Belingheri, Lorena I. Ibañez, Scott E. Javis, H.W. Tedford, Gerald Zamponi, y Fernando D. Marengo. The immediately releasable pool of mouse chromaffin cell vesicles is coupled to P/Q calcium channels by the synaptic protein interaction site. PLoS ONE 8 (1): e54846. doi:10.1371/journal.pone.0054846, 2013.
Andrés Pérez Bay, Ana V. Belingheri, Y.D. Álvarez y Fernando D Marengo. The Excess Retrieval Mode of Rapid Endocytosis Produces both Non-Releasable Endosomes and Rapidly Recovered Releasable Vesicles in Mouse Chromaffin Cells. Acta Physiologica (ex Acta Physiologica Scandinavica) 204: 403-418, 2012
Yanina D. Álvarez y Fernando D. Marengo. The Immediately Releasable Vesicle Pool. Highly Coupled Secretion in Chromaffin and other Neuroendocrine Cells. Journal of Neurochemistry 116: 155-163, 2011
Andrés Pérez Bay, Lorena I. Ibañez y Fernando D Marengo. Rapid recovery of releasable vesicles and formation of non-releasable endosomes follow intense exocytosis en chromaffin cells. Am J Physiol. Cell Physiol. 293(5): C1509-C1522, 2007.
Yanina D. Álvarez, Lorena I. Ibañez, O. Uchitel , F. D. Marengo. P/Q Ca2+ Channels are Functionally Coupled to Immediately Releasable Pool Exocytosis in Mouse Chromaffin Cells. Cell Calcium 43: 155-164, 2008.
- Fernando D. Marengo. Calcium Gradients and Exocytosis in Adrenal Chromaffin Cells. Cell Calcium 38: 87-99, 2005.
-
noticias marengo
28/10/2019 Noticias / Medios - Marengo
Integrantes del grupo

Dra. Luciana I. Gallo
Investigadora CONICET

Dra. Luciana I. Gallo
Investigadora CONICET
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Bioquímico Octavio Caspe
Becario CONICET

Bioquímico Octavio Caspe
Becario CONICET
- Phone:+549 (11) 2546-6589
- Email:info@example.com

LIcenciada María Pilar Canal
Becaria CONICET

LIcenciada María Pilar Canal
Becaria CONICET
- Phone:+549 (11) 2546-6589
- Email:info@example.com
Miembros Anteriores

Dr. Samuel A. Alfonso Bueno.
Ex Tesista de Doctorado

Dr. Samuel A. Alfonso Bueno.
Ex Tesista de Doctorado
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dr. Lucas Bayonés
Ex Tesista de Doctorado. Presente: PosDoc IFC - UNAM - México

Dr. Lucas Bayonés
Ex Tesista de Doctorado. Presente: PosDoc IFC - UNAM - México
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dra. Verónica Belingheri
Ex Tesista de Doctorado. Presente: Docente Universidad de Luján

Dra. Verónica Belingheri
Ex Tesista de Doctorado. Presente: Docente Universidad de Luján
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dr. Andrés Perez Bay
Ex Tesista de Doctorado. Presente: Staff Scientist at Regeneron Pharmaceuticals, Inc. New York. Estados Unidos

Dr. Andrés Perez Bay
Ex Tesista de Doctorado. Presente: Staff Scientist at Regeneron Pharmaceuticals, Inc. New York. Estados Unidos
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dr. Mauricio Montenegro
Ex Tesista de Doctorado. Presente: PosDoc ANPCyT. Fac Medicina

Dr. Mauricio Montenegro
Ex Tesista de Doctorado. Presente: PosDoc ANPCyT. Fac Medicina
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dr. José Moya-Díaz
Ex Tesista de Doctorado. Presente:Wellcome Trust Research Fellow. University of Sussex. Brighton. Reino Unido

Dr. José Moya-Díaz
Ex Tesista de Doctorado. Presente:Wellcome Trust Research Fellow. University of Sussex. Brighton. Reino Unido
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dra. Yanina D. Álvarez
Ex Tesista de Doctorado. Presente: Research Fellow. University of Warwick, Coventry, United Kingdom

Dra. Yanina D. Álvarez
Ex Tesista de Doctorado. Presente: Research Fellow. University of Warwick, Coventry, United Kingdom
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Dra. Lorena Itatí Ibañez.
Ex Tesista de Licenciatura. Presente: Investigadora Adjunta de CONICET. Facultad de Ciencias Exactas y Naturales. UBA.

Dra. Lorena Itatí Ibañez.
Ex Tesista de Licenciatura. Presente: Investigadora Adjunta de CONICET. Facultad de Ciencias Exactas y Naturales. UBA.
- Phone:+549 (11) 2546-6589
- Email:info@example.com