Línea de Investigación:
Estudio neuroanatómico y funcional de centros claves en la integración visuo-motora
Mi línea de investigación se centra en el estudio de las zonas del cerebro de cangrejos que procesan distintos tipos de propiedades visuales. Nuestros proyectos involucran desde el estudio de neuronas particulares, entender la función de una determinada población de neuronas o estructura en el cerebro a estudiar el comportamiento de los animales. Me interesa también aportar al debate sobre la evolución dentro de artrópodos por lo que trabajamos realizando descripciones anatómicas y fisiológicas detalladas que puedan ser comparadas con otros taxones.
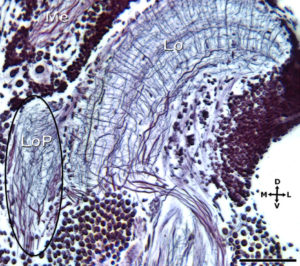
Recientemente describimos en el cangrejo Neohelice granulata una pequeña región cerebral que dada su similar conectividad, características retinotópicas, y cantidad de capas se cree similar a la lobula plate de dípteros (Bengochea, Berón de Astrada, Tomsic and Sztarker, 2018). En dípteros, la lobula plate lleva a cabo, por un lado, el procesamiento de la información de flujo óptico generada en la retina por el movimiento propio del animal o por movimientos globales del panorama visual y por el otro, el control de la respuesta optomotora y la trayectoria de desplazamiento.
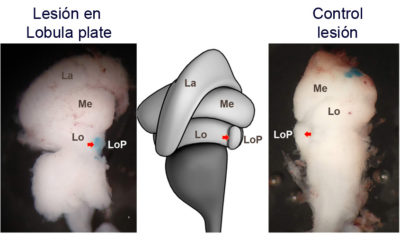
Nuestra hipótesis es que el control de las respuestas optomotoras en crustáceos también está, como en insectos, mediado por la lobula plate. Para juntar evidencias que apoyen esta hipótesis, realizamos lesiones electrolíticas de esta región y evaluamos los cambios producidos en el comportamiento optomotor en los cangrejos lesionados en la lobula plate vs animales lesionados en otras regiones. Los animales son también evaluados en cuanto a su respuesta de escape ante un estímulo potencialmente peligroso para tener un control de un comportamiento que debería estar controlado por una vía neuronal independiente. Nuestros resultados demostraron que la función de la lóbula plate de cangrejos es similar a la de moscas (Barnatan et al 2022).
Estamos realizando ahora registros electrofisiológicos en esta región para poder caracterizar fisiológica y morfológicamente a las neuronas tangenciales presentes en este pequeño neuropilo.
A través de diversas técnicas histológicas (Bodian, Golgi, tinciones intracelulares, tinciones en masa utilizando dextranos) estudiamos la neuroarquitectura y organización de las estructuras cerebrales (neuropilos), especializándonos pero no restringiéndonos a estructuras que procesan información visual.
Esto nos permite conocer la conectividad, la cantidad de capas sinápticas contenidas en un neuropilo, identificar los pequeños elementos neuronales que componen los neuropilos pero que no puede ser registrados fácilmente con técnicas de electrofisiología.

La presencia de dos ojos en un animal permite la combinación de la información obtenida por cada ojo facilitando, entre otras cosas, la ampliación de campo receptivo, la mejora de la relación señal/ruido en las imágenes percibidas, la integración de señales de flujo óptico y, en algunos casos, la estimación de distancia utilizando el mecanismo de estereopsis. Si bien la estereopsis es utilizada por un gran número de animales, existen hasta el momento sólo 2 ejemplos descriptos en invertebrados: la mantis y la sepia. El cangrejo Neohelice granulata tiene dos ojos pedunculados, lo suficientemente separados para hacer factible la estimación de distancia por estereopsis, con una distribución de omatidias que permite un campo receptivo de 360 grados para cada ojo. El objetivo de esta línea de investigación es entender qué tipo de comportamientos se benefician del uso de visión binocular y qué tipos de mecanismos están involucrados (sumación de campo, estereopsis). Para esto, estudiamos diversos comportamientos del cangrejos guiados por la visión, incluyendo la respuesta optomotora, la navegación espontánea y ante estímulos apetitivos que desencadenen respuestas de acercamiento (caza). Evaluamos la respuesta de los cangrejos en condiciones de visión completa o ante condiciones de visión reducida (visión monocular o con distintas zonas del ojo ocluidas con pintura).
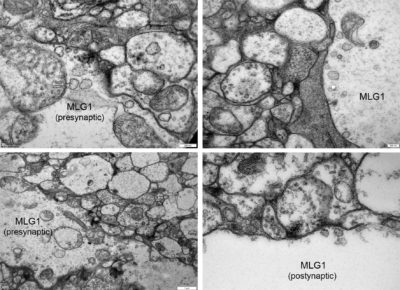
La mayoría de los animales pueden realizar la detección visual de objetos en trayectoria de colisión. Entre sus beneficios están poder escapar de predadores acercándose, atrapar presas o simplemente evitar colisionar con objetos al desplazarse. Esta habilidad recae en la presencia de neuronas llamadas detectoras de colisión que están especializadas en responder únicamente a estímulos que se acercan en una vía de colisión directa. En langostas se han estudiado intensamente neuronas de este tipo, las lobula giant movement detector neurons, LGMDs. Se ha propuesto que la habilidad de detectar colisión está relacionada a la presencia de un arreglo sináptico particular que poseen las neuronas columnares presinápticas a las LGMDs (Rind and Simmons, 1998). En estudios de microscopía electrónica se ha descripto que este arreglo implica sinápsis diádicas en donde hay dos perfiles postsinápticos por cada densidad presináptica. Es decir que cada neurona columnar sinapta con su vecina además de con la LGMD. Se propone que este arreglo permite una carrera entre la ola de excitación y la de inhibición producida por la imagen de un objeto acercándose que modela la selectividad de respuesta de estos detectores de colisión. En cangrejos, hemos descripto dentro de las neuronas LG (lobula giants) dos subclases, MLG1 y MLG2, que muestran propiedades de detectoras de colisión (Medan et al, 2007; Oliva and Tomsic 2014, 2016). Estamos llevando a cabo un proyecto, en colaboración con la Universidad de Newcastle, donde estamos estudiando las conexiones sinápticas de las MLG1. El encontrar un arreglo sináptico similar entre cangrejos y langostas podrían respaldar una relación filogenética fuerte entre los grupos de insectos y crustáceos. Por otro lado, el encontrar un arreglo sináptico distintos nos podría dar claves de que existen otros circuitos alternativos igualmente eficientes de computar la información para detectar objetos en trayectoria de colisión directa.
-

Nuestro modelo de estudio
-

-“Predatory behavior under monocular and binocular conditions in the semiterrestrial crab Neohelice granulata“. Thomas Harper, Sergio Iván Nemirovsky, Daniel Tomsic and Julieta Sztarker. Frontiers in Behavioral Neuroscience. 17:1186518.doi:10.3389/fnbeh.2023.1186518, 2023
-“Matched function of the neuropil processing optic flow in flies and crabs: the lobula plate mediates optomotor responses in Neohelice granulata” Yair Barnatan, Daniel Tomsic, Alejandro Cámera and Julieta Sztarker. Proceedings of the Royal Society B. 289: 20220812, 2022.
-“Neural organization of the third optic neuropil, the lobula, in the highly visual semiterrestrial crab Neohelice granulata”. Lepore MG, Tomsic D, Sztarker J. Journal of Comparative Neurology. 530:1533-1550, 2022.
–Direction Selective Neurons Responsive to Horizontal Motion in a Crab Reflect an Adaptation to Prevailing Movements in Flat Environments. Scarano F, Tomsic D, Sztarker J. Journal of Neuroscience. 40:5561-5571, 2020.
-A crabs’ high-order brain center resolved as a mushroom body-like structure. Maza FJ, Sztarker J, Cozzarin ME, Lepore MG, Delorenzi A. Journal of Comparative Neurology. 2020. doi: 10.1002/cne.24960.
-Unidirectional Optomotor Responses and Eye Dominance in Two Species of Crabs. Yair Barnatan, Daniel Tomsic and Julieta Sztarker*. Frontiers in Physiology. https://doi.org/10.3389/fphys.2019.00586. 2019.
–Binocular neuronal processing of object motion in an arthropod. Florencia Scarano, Julieta Sztarker, Violeta Medan, Martín Berón de Astrada, Daniel Tomsic. Journal of Neuroscience. 38:6933– 6948, 2018.
-A crustacean lobula plate: morphology, connections and retinotopic organization. Bengochea M; Tomsic D, Berón de Astrada M, Sztarker J. Journal of Comparative Neurology. 256: 109-119, 2018.
-Differential processing in modality-specific Mauthner cell dendrites. Violeta Medan, Tuomo Maki-Marttunen, Julieta Sztarker and Thomas Preuss. J Physiol 596: 667–689, 2018
-The predator and prey behaviors of crabs: from ecology to neural adaptations. Tomsic D, Sztarker J, Berón de Astrada M, Oliva DE, Lanza E. Journal of Experimental Biology, 220: 2318-2327, 2017.
-Two identified looming detectors in the locust: ubiquitous lateral connections among their inputs contribute to selective responses to looming objects. F.C Rind, S Wernitznig, P Polt, A Zankel, D Gütl, J Sztarker, and G Leitinger. Scientific Reports 6:35525, 2016.
–Context-dependent memory traces in the crabs’ mushroom body: functional support for a common origin of high-order memory centers. FJ Maza, J Sztarker, A Shkedy, VN Peszano, FF Locatelli, A Delorenzi, PNAS 113: 7957-7965, 2016.
–A look into the cockpit of the developing locust: looming detectors and predator avoidance. Sztarker J, Rind FC. Developmental neurobiology 74: 1078-95, 2014.
-Neural organization of the second optic neuropil, the medulla, in the highly visual semiterrestrial crab Neohelice granulata. Sztarker J and Tomsic D. Journal of Comparative Neurology 522: 3177-3193, 2014
-Looming detection by identified visual interneurons during larval development of the locust, Locusta migratoria. Peter J Simmons, Julieta Sztarker and Claire Rind. Journal of Experimental Biology, 216: 2266-2275, 2013.
–Behaviorally Related Neural Plasticity in the Arthropod Optic Lobes. Martín Berón de Astrada, Mercedes Bengochea, Julieta Sztarker, Alejandro Delorenzi, and Daniel Tomsic. Current Biology 23, 1–10, August 5, 2013.
– Brain modularity in arthropods: Individual neurons that support “what” but not “where” memories. Sztarker J, Tomsic D. Journal of Neuroscience, 31(22):8175– 8180, 2011.
–Neural organization of first optic neuropils in the littoral crab Hemigrapsus oregonensis and the semiterrestrial species Chasmagnathus granulatus. Sztarker J, Strausfeld N, Andrew D, Tomsic D. Journal of Comparative Neurology, Mar 10;513(2):129-50, 2009
-Behavioral and neuronal attributes of short- and long-term habituation in the crab Chasmagnathus. Tomsic D, de Astrada MB, Sztarker J, Maldonado H. Neurobiol Learn Mem. 2009Epub 2009 Jan 30. 92:176-82, 2009.
-Neuronal correlates of the visually elicited escape response of the crab Chasmagnathus upon seasonal variations, stimuli changes and perceptual alterations. Sztarker J, Tomsic D. J Comp Physiol A, 194:587-596, 2008
-Organization of optic lobes that support motion detection in a semiterrestrial crab. Sztarker J., Strausfeld N.J.,Tomsic D. Journal of Comparative Neurology, 493: 396-411, 2005
-Binocular visual integration in the crustacean nervous system. Sztarker J., Tomsic D. Journal of Comparative Physiology A, 190:951-962, 2004
-Identification of individual neurons reflecting short- and long-term visual memory in an arthropod. Tomsic D, Berón de Astrada M, Sztarker J. Journal of Neuroscience 23: 8539-8546, 2003
-Visual interneurons of the crab Chasmagnathus studied by intracellular recordings in vivo. Berón de Astrada M.; Sztarker J.; Tomsic D., Journal of Comparative Physiology A, 187: 37-44, 2001
Neohelice granulata” Yair Barnatan, Daniel Tomsic, Alejandro Cámera and Julieta Sztarker. Proceedings of the Royal Society B. 289: 20220812, 2022.
2022-2025 Proyectos de Investigación Científica y Tecnológica (PICT-2020- Serie A-00867) Monto $ 1.909.845. Participación: Directora
2021-2024 Subsidio Conicet: PIP GI: 11220200101248CO. Monto $ 850.000 Participación: Directora
2018-2021. Subsidio Ubacyt. Monto $112.000. Participación: Co-directora
2018-2022. EU Research and Innovation Staff Exchange (RISE) H2020-MSCA-RISE-2017, project nº 778062 – ULTRACEPT. € 1.894.500 Participación: Investigador Integrante
2017-2020 Proyectos de Investigación Científica y Tecnológica. (PICT-2016-0196). Monto: $ 390.000 Participación: Directora
2017-2020 Proyectos de Investigación Científica y Tecnológica. (PICT-2016-1946). Monto: $ 810.000 Participación: Investigador Integrante
2015-2019. EU Research and Innovation Staff Exchange (RISE) H2020-MSCA-RISE-2015, project nº 691154 – STEP2DYNA. Monto: €1.008.000 Participación: Investigador Integrante
2014-2017. Subsidio Ubacyt. Monto $100 000. Participación: Investigador formado
2014-2017. Proyectos de Investigación Científica y Tecnológica (PICT-2013-0450) Monto $ 420.000. Participación: Investigador Integrante
2013-2015 (1º de julio de 2013 hasta el 31 de diciembre de 2015) Subsidio Ubacyt Joven. Monto $12 000. Participación: Directora
2012-2016. Proyectos de Investigación Científica y Tecnológica. Temas abiertos- Jóvenes (PICT-2012-0381). Monto: $ 60.000 Participación: Directora
2012-2016. EU FP7-PEOPLE-2011-IRSES proposal n° 295151 – acronym: LIVCODE. Monto: € 724.500 Participación: Investigador Integrante
2012-2014. Subsidio Conicet: PIP GI nº 112 201301 00729 CO. Monto $ 100.000. Participación: Co-director
2011-2012. Marie Curie Actions. International Incoming Fellowships (IIF). FP7-PEOPLE-IIF-2008. Monto: € 15.000. Participación: Directora
2009-2011. Marie Curie Actions. International Incoming Fellowships (IIF). FP7-PEOPLE-IIF-2008. Monto: € 19.200. Participación: Investigador responsable
2010-2013. Proyectos de Investigación Científica y Tecnológica (PICT 2010-1016). Monto: $ 280.000,00 Participación: Investigador Responsable
2011-2014. Subsidio Ubacyt. Monto: $ 84.000,00 Participación: Investigador formado
2008-2011. Subsidio Ubacyt. Monto: $ 36.000,00 Participación: Investigador
2007-2010 Subsidio Agencia Nacional de Promoción Científica y Tecnológica – ANPCY Monto: $ 280.000,00 Participación: Investigador
2004-2007. Subsidio Ubacyt para Investigadores Formados X172. Monto $45.000. Participación: Miembro del equipo
2003-2006. Subsidio PICT No 12300 de la ANPCyT. $200.000 por 3 años. Participación: Miembro del equipo
2003. Subsidio Ubacyt para Investigadores Jóvenes. Monto $6.000. Participación: Miembro del equipo
2003. Renovación del Subsidio de Emergencia. Fundación Antrochas. $9.000. Participación: Miembro del equipo
2002. Subsidio de Emergencia. Fundación Antrochas. Monto $18900. Participación: Miembro del equipo
2002. Subsidio de Cooperación Internacional, Fundación Antorchas. Monto US$7.000. Participación: Miembro del equipo
2000. Subsidio de Apoyo a la Investigación, Fundacion Antorchas. Monto $7.000. Participación: Miembro del equipo
1999-2000. Subsidio CONICET. Monto $9.800. Participación: Miembro del equipo
1999. Subsidio de Apoyo a la Investigación, Fundacion Antorchas. Monto $7.000. Participación: Miembro del equipo
Integrantes del grupo

Yair Barnatan
Becario Doctoral

Yair Barnatan
Becario Doctoral
- Phone:+549 (11) 2546-6589
- Email:info@example.com

María Grazia Lepore
Becaria Doctoral

María Grazia Lepore
Becaria Doctoral
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Ana Pavlova Contreras Vera
Becaria Doctoral - Conicet

Ana Pavlova Contreras Vera
Becaria Doctoral - Conicet
- Phone:+549 (11) 2546-6589
- Email:apavlovac@gmail.com

Emiliano Kalesnik Vissio
Estudiante (Beca CIN)

Emiliano Kalesnik Vissio
Estudiante (Beca CIN)
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Ariana Bertot
Estudiante

Ariana Bertot
Estudiante
- Phone:+549 (11) 2546-6589
- Email:apavlovac@gmail.com
Miembros Anteriores
Florencia Scarano
Thomas Harper
Compartir en Redes Sociales
-“Predatory behavior under monocular and binocular conditions in the semiterrestrial crab Neohelice granulata“. Thomas Harper, Sergio Iván Nemirovsky, Daniel Tomsic and Julieta Sztarker. Frontiers in Behavioral Neuroscience. 17:1186518.doi:10.3389/fnbeh.2023.1186518, 2023.
-“Matched function of the neuropil processing optic flow in flies and crabs: the lobula plate mediates optomotor responses in Neohelice granulata” Yair Barnatan, Daniel Tomsic, Alejandro Cámera and Julieta Sztarker. Proceedings of the Royal Society B. 289: 20220812, 2022.
-“Neural organization of the third optic neuropil, the lobula, in the highly visual semiterrestrial crab Neohelice granulata”. Lepore MG, Tomsic D, Sztarker J. Journal of Comparative Neurology. 530:1533-1550, 2022.
–Direction Selective Neurons Responsive to Horizontal Motion in a Crab Reflect an Adaptation to Prevailing Movements in Flat Environments. Scarano F, Tomsic D, Sztarker J. Journal of Neuroscience. 40:5561-5571, 2020.
-A crabs’ high-order brain center resolved as a mushroom body-like structure. Maza FJ, Sztarker J, Cozzarin ME, Lepore MG, Delorenzi A. Journal of Comparative Neurology. 2020. doi: 10.1002/cne.24960.
-Unidirectional Optomotor Responses and Eye Dominance in Two Species of Crabs. Yair Barnatan, Daniel Tomsic and Julieta Sztarker*. Frontiers in Physiology. https://doi.org/10.3389/fphys.2019.00586. 2019.
–Binocular neuronal processing of object motion in an arthropod. Florencia Scarano, Julieta Sztarker, Violeta Medan, Martín Berón de Astrada, Daniel Tomsic. Journal of Neuroscience. 38:6933– 6948, 2018.
-A crustacean lobula plate: morphology, connections and retinotopic organization. Bengochea M; Tomsic D, Berón de Astrada M, Sztarker J. Journal of Comparative Neurology. 256: 109-119, 2018.
-Differential processing in modality-specific Mauthner cell dendrites. Violeta Medan, Tuomo Maki-Marttunen, Julieta Sztarker and Thomas Preuss. J Physiol 596: 667–689, 2018
-The predator and prey behaviors of crabs: from ecology to neural adaptations. Tomsic D, Sztarker J, Berón de Astrada M, Oliva DE, Lanza E. Journal of Experimental Biology, 220: 2318-2327, 2017.
-Two identified looming detectors in the locust: ubiquitous lateral connections among their inputs contribute to selective responses to looming objects. F.C Rind, S Wernitznig, P Polt, A Zankel, D Gütl, J Sztarker, and G Leitinger. Scientific Reports 6:35525, 2016.
–Context-dependent memory traces in the crabs’ mushroom body: functional support for a common origin of high-order memory centers. FJ Maza, J Sztarker, A Shkedy, VN Peszano, FF Locatelli, A Delorenzi, PNAS 113: 7957-7965, 2016.
–A look into the cockpit of the developing locust: looming detectors and predator avoidance. Sztarker J, Rind FC. Developmental neurobiology 74: 1078-95, 2014.
-Neural organization of the second optic neuropil, the medulla, in the highly visual semiterrestrial crab Neohelice granulata. Sztarker J and Tomsic D. Journal of Comparative Neurology 522: 3177-3193, 2014
-Looming detection by identified visual interneurons during larval development of the locust, Locusta migratoria. Peter J Simmons, Julieta Sztarker and Claire Rind. Journal of Experimental Biology, 216: 2266-2275, 2013.
–Behaviorally Related Neural Plasticity in the Arthropod Optic Lobes. Martín Berón de Astrada, Mercedes Bengochea, Julieta Sztarker, Alejandro Delorenzi, and Daniel Tomsic. Current Biology 23, 1–10, August 5, 2013.
– Brain modularity in arthropods: Individual neurons that support “what” but not “where” memories. Sztarker J, Tomsic D. Journal of Neuroscience, 31(22):8175– 8180, 2011.
–Neural organization of first optic neuropils in the littoral crab Hemigrapsus oregonensis and the semiterrestrial species Chasmagnathus granulatus. Sztarker J, Strausfeld N, Andrew D, Tomsic D. Journal of Comparative Neurology, Mar 10;513(2):129-50, 2009
-Behavioral and neuronal attributes of short- and long-term habituation in the crab Chasmagnathus. Tomsic D, de Astrada MB, Sztarker J, Maldonado H. Neurobiol Learn Mem. 2009Epub 2009 Jan 30. 92:176-82, 2009.
-Neuronal correlates of the visually elicited escape response of the crab Chasmagnathus upon seasonal variations, stimuli changes and perceptual alterations. Sztarker J, Tomsic D. J Comp Physiol A, 194:587-596, 2008
-Organization of optic lobes that support motion detection in a semiterrestrial crab. Sztarker J., Strausfeld N.J.,Tomsic D. Journal of Comparative Neurology, 493: 396-411, 2005
-Binocular visual integration in the crustacean nervous system. Sztarker J., Tomsic D. Journal of Comparative Physiology A, 190:951-962, 2004
-Identification of individual neurons reflecting short- and long-term visual memory in an arthropod. Tomsic D, Berón de Astrada M, Sztarker J. Journal of Neuroscience 23: 8539-8546, 2003
-Visual interneurons of the crab Chasmagnathus studied by intracellular recordings in vivo. Berón de Astrada M.; Sztarker J.; Tomsic D., Journal of Comparative Physiology A, 187: 37-44, 2001
Neohelice granulata” Yair Barnatan, Daniel Tomsic, Alejandro Cámera and Julieta Sztarker. Proceedings of the Royal Society B. 289: 20220812, 2022.